Redox-Flow-Technologie
Der Begriff Redox ist ein Kurzwort aus „Red“ (für Reduktion) und „Ox“ (für Oxidation). Er bezeichnet eine chemische Reaktion, bei der Elektronen abgegeben werden (Oxidation) und von einem Reaktionspartner aufgenommen werden (Reduktion). Bei diesem Prozess wird elektrische Energie freigesetzt oder chemisch gebunden.
Forschungen hierzu begannen in der Mitte des 20. Jahrhunderts. 1986 patentierten Maria Skyllas-Kazacos und ihr Team der University of New South Wales mit der Vanadium-Redox-Flow-Batterie den ersten elektrochemischen Energiespeicher.
Die Technologie basiert auf der Speicherung elektrischer Energie, die aus dem Potenzialunterschied resultiert, wenn zwei Redox-Paare miteinander reagieren. Der wesentliche Unterschied zu anderen Batterietechnologien ist – neben der Energiedichte – dass sich die Reaktionspartner des Speichermediums in gelöster Form als Elektrolyte in Tanks befinden. Neben Vanadium-Schwefelsäure als Elektrolyt gibt es heute eine Reihe unterschiedlich aufgebauter Elektrolyte auf metallischer und organischer Basis.
Aufbau und Funktionsweise einer Redox-Flow-Batterie
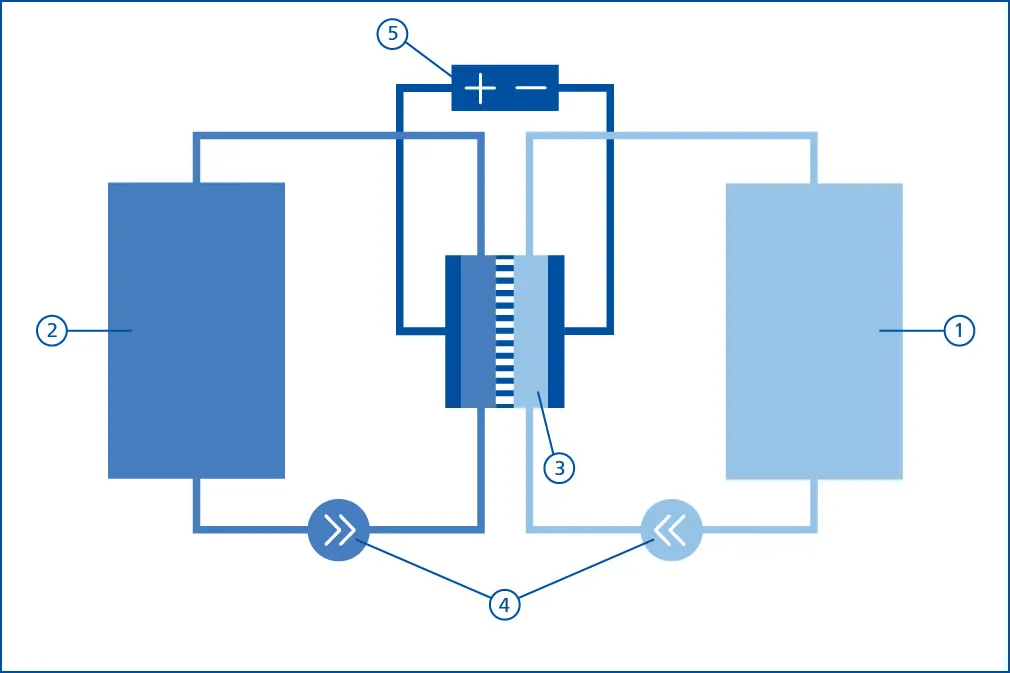
Eine Redox-Flow-Batterie besteht aus 5 Hauptkomponenten:
| Nummer | Hauptkomponente |
|---|---|
| 1 | Anolyttank |
| 2 | Katholyttank |
| 3 | Elektrochemische Wandler (Stack) |
| 4 | Fluidsystem inkl. Pumpen, Sensorik und Aktorik |
| 5 | Leistungselektronik inkl. Netzanbindung |
Jede Redox-Flow-Batterie nutzt zwei Tanks, in denen die Elektrolyte gelagert werden. Ein Tank enthält den negativ geladenen Elektrolyt (Katholyt), der andere Tank enthält den positiv geladenen Elektrolyt (Anolyt).
Der Stack ist aus einer definierten Anzahl an einzelnen Batteriezellen aufgebaut, wobei jede Halbzelle durch eine Ionen-Tauscher-Membran geteilt ist. Die Batteriezellen sind jeweils durch eine fluiddichte, leitfähige Bipolarplatte getrennt. Die eigentliche elektrochemische Reaktion findet in den Graphit-Filzen der Halbzellen statt, die vom jeweiligen positiven oder negativen Elektrolyt durchströmt werden. Um die Batterie zu laden oder zu entladen, wird der Elektrolyt mithilfe von Pumpen durch den Stack befördert. Sobald eine elektrische Last am Stack anliegt, beginnt die elektrochemische Reaktion: Der Strom fließt und dem Elektrolyt wird die Ladung entzogen. Um die Elektrolyte wieder aufzuladen, wird eine äußere Spannung angelegt, sodass die Reaktion umgekehrt verläuft.
Die Energiedichte der Batterie hängt vom jeweiligen Elektrolyten ab. Bei der kommerziell am verbreitetsten Variante der Vanadium-Redox-Flow-Technologie liegt sie in der Praxis bei 15 bis 20 Wh/Liter.
FAQ
1. Kann man bei Schmalz komplette, anschlussfertige Batterien kaufen?
Nein. Schmalz ist Hersteller von Komponenten und Teilsystemen. Schmalz entwickelt und produziert die Leistungskomponente (Stack) einer Redox-Flow-Batterie und stattet diese bei Bedarf mit Peripherie (Sensorik, etc.) aus. Die Stacks von Schmalz werden von Systemintegratoren in deren Komplettsystemen eingesetzt.
2. Speichert der Stack Strom?
Nein. Der Stack ist für das Laden und Entladen einer Flüssigkeit (Elektrolyt) zuständig. Die elektrische Energie wird in der Flüssigkeit chemisch gespeichert. Der Stack ist also der elektrochemische Wandler einer Redox-Flow-Batterie.
3. Kann ein Stack mit anderen Elektrolyten betrieben werden?
Grundsätzlich ja. Allerdings sind häufig Modifikationen notwendig. Es muss vorab immer geprüft werden, inwiefern der Elektrolyt zu den Komponenten im Stack passt.
4. Gibt es Stacks mit unterschiedlichen Leistungsklassen?
Ja. Die Leistung eines Stacks resultiert aus der Zahl der Zellen. Diese kann individuell angepasst werden.
5. Ist die Anzahl von Zellen innerhalb eines Stacks begrenzt?
Die Anzahl von Zellen in einem Stack ist in der Praxis durch elektrochemische Vorgänge limitiert – abhängig vom eingesetzten Elektrolyt.
6. Können die Fluid-Anschlüsse modifiziert werden?
Ja. Schmalz verwendet standardisierte Anschlüsse, die bei Bedarf angepasst werden können.